Isatine
Modèle:Infobox Chimie L'isatine, tribuline ou indole-2,3-dione est un composé aromatique bicyclique dérivé de l'indole, de formule brute Modèle:Fchim.
L'istatine est un produit naturel bien connu que l'on trouve dans les plantes du genre Isatis, dans Couroupita guianensis[1]Modèle:,[2], mais également chez les humains, comme dérivé métabolique de l'adrénaline[3].
Elle se présente sous la forme d'une poudre rouge-orangé. Elle est généralement utilisée comme élément de base pour la synthèse d'une grande variété de composés biologiquement actifs, notamment des antitumoraux[4], des antiviraux[5], en particulier des anti-VIH[6], et des antituberculeux[7].
Histoire
L'istatine a été obtenue pour la première fois simultanément par le chimiste allemand Otto Linné Erdmann[8] et le chimiste français Auguste Laurent[9] en 1840 comme produit d'oxydation de l'indigotine par l'acide nitrique et l'acide chromique, mais ce n'est qu'en 1878 qu'Adolf von Baeyer réussit à la synthétiser complètement. En 1880, il développe une méthode de synthèse à partir de l'acide o-nitrocinnamique, et il brevète en 1883 une méthode de synthèse à partir du 2-nitrobenzaldéhyde, avec pour finalité la production synthétique de teinture indigo.
Dérivés

On appelle « isatines » les dérivés de l'isatine pour lesquels le cycle benzénique est substitué[10].
Des recherches sont menées sur la base de Schiff de l'isatine pour ses propriétés pharmaceutiques[11].
L'isatine forme un colorant bleu appelé indophénine quand il est mélangé avec de l'acide sulfurique et du benzène brut (non purifié). La formation de l'indophénine a longtemps été perçue comme une réaction avec le benzène. Cependant, Viktor Meyer réussit finalement à isoler la vraie substance du benzène brut responsable de cette réaction. Il s'agit du thiophène, un composé hétérocyclique[12].
On retrouve le noyau d'isatine dans les composés constituant les pigments « bleu maya » et « jaune maya »[13]. Modèle:Clr
Synthèse
L'isatine est disponible dans le commerce, et il existe plusieurs méthodes pour la synthétiser.
Méthode de Sandmeyer
La méthode de Sandmeyer est la plus ancienne et la plus directe façon de synthétiser l'isatine ; elle a été découverte par le chimiste suisse Traugott Sandmeyer en 1919[14]. Elle consiste en la condensation entre l'hydrate de chloral et une arylamine primaire, par exemple l'aniline, en présence de chlorure d'hydroxylammonium dans une solution aqueuse de sulfate de sodium pour former un α‐isonitrosoacétanilide. Cet intermédiaire est isolé puis subit une cyclisation électrophile favorisée par les acides forts (par exemple l'acide sulfurique), avec un rendement supérieur à Modèle:Nobr[15].

Méthode de Stollé
La méthode de Stollé est considérée comme la meilleure alternative à celle de Sandmeyer pour la synthèse d'isatines substituées ou non[16]. Elle consiste en la condensation entre une arylamine primaire ou secondaire avec le chlorure d'oxalyle pour former un intermédiaire chloro-oxalylanilide qui est ensuite cyclisé en présence d'un acide de Lewis (par exemple le chlorure d'aluminium, le tétrachlorure de titane, le trifluorure de bore, etc.).

Autre méthodes
Une autre réaction de synthèse classique mise au point également par Sandmeyer en 1906, démarre avec la diphénylthiourée (φNH-CS-NHφ) , du cyanure de potassium et du carbonate de plomb[17].
Les isatines peuvent être aussi formées avec un bon rendement à partir de l'indole correspondant en le mélangeant avec du chlorure d'indium(III) (InCl3) et de l'acide 2-iodoxybenzoïque (IBX) dans une solution d'eau-acétonitrile à Modèle:Tmp[18].
Des approches modernes de la synthèse d'isatines N-substituées incluent l'oxydation d'indoles ou d'oxindoles substituées disponibles dans le commerce avec divers oxydants, par exemple le TBHP[19], l'acide 2-iodoxybenzoïque (IBX)[20], le nitrite de butyle[21], etc.

Réactivité
La présence d'un cycle aromatique, d'une fonction cétone, et d'un cycle γ-lactame donnent à l'isatine le potentiel rare d'être à la fois utilisé comme électrophile et nucléophile. Elle est capable de subir de nombreuses réactions, comme des N-substitutions, des substitutions électrophiles aromatiques en position C-5 et C-7 du cycle benzénique, des additions nucléophiles sur le C-3 (groupe carbonyle), des réductions ou oxydations chimiosélectives, de expansions de cycle et des spiro-annélations. Du fait de cette réactivité unique, l'isatine est considérée comme l'un des éléments de base les plus précieux en synthèse organique.
N-Substitution
La N-fonctionnalisation du noyau d'isatine est facilement obtenue par la déprotonation de la partie amino, formant le sel de sodium ou de potassium correspondant, et permet l'addition ultérieure d'un électrophile (par exemple un halogénure d'alkyle ou un halogénure d'acyle).

La N-arylation est par contre généralement faite par des réactions de couplage croisé avec des halogénures d'aryle en utilisant des catalyseurs au cuivre ou au palladium[22]Modèle:,[23].
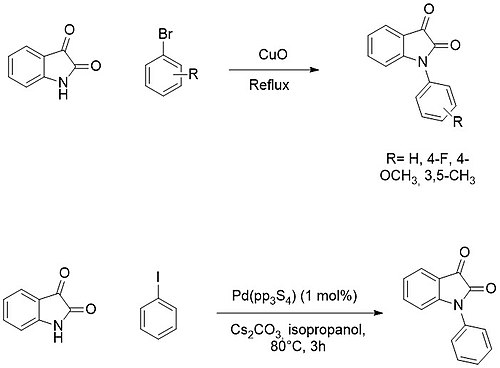
Expansion de cycle
En synthèse organique, les expansions de cycles sont considérées comme des réactions précieuses car elles permettent d'obtenir des cycles de taille moyenne (7-9 atomes) qui sont difficiles à synthétiser par les méthodes « classiques »[24]
À ce jour, seuls quelques articles concernant l'expansion du cycle des dérivés de l'isatine ont été publiés. Le premier est une réaction monotope multicomposants sous catalyse acide, impliquant des isatines, des amino-uraciles et des isoxazolones pour former des isoxazoquinoléines, échafaudages importants en chimie médicinale[25].

Dans une autre une réaction monotope multicomposants, une expansion unique à deux atomes de carbone a été obtenue en faisant réagir l'isatine avec l'indène-1,3-dione et un bromure de pyridinium N-substitué pour former une dibenzo[b,d]azépin-6-one[26].

La réaction de Pftizinger est un autre exemple d'expansion du cycle de l'isatine.
Addition nucléophile C-2/C-3
L'isatine peut subir une addition nucléophile sur les carbonyles aux positions C-2 et C-3. La régiosélectivité du processus dépend fortement à la fois du substrat (propriétés des substituants sur le noyau d'isatine, en particulier ceux liés à l'atome d'azote) et des conditions de réaction (solvant, température, etc.). Dans certains cas, l'addition nucléophile peut être suivie une autre réaction (cyclisation, expansion du cycle, ouverture du cycle, etc.).

Oxydation
L'oxydation de l'isatine par le peroxyde d'hydrogène ou l'anhydride chromique produit l'anhydride isatoïque[28]Modèle:,[29], un composé très utilisé, dans certains herbicides ou en chimie médicale.

Dimérisation
La dimérisation de l'isatine avec KBH4 dans le méthanol produit l'indirubine[30]. C'est le pendant rouge de la teinture d'indigo, qui présente également une grande cytotoxicité.

Réduction
La réduction du groupe carbonyle en C-3 (non-amide) donne l'oxindole.
Notes et références
Modèle:Traduction/Référence Modèle:Références
Voir aussi
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Piyasena Hewawasam, Nicholas A. Meanwell, A General Method for the Synthesis of Isatins: Preparation of regiospecifically functionalized isatins from anilines, Tetrahedron Letters, 1994, vol. 35(40), pp. 7303–7306. Modèle:DOI.
- ↑ A. A. Jarrahpour, D. Khalili, Synthesis of 3,3´-[methylenebis(3,1-phenylenenitrilo)]bis[1,3-dihydro]-2H-indol-2-one as a Novel bis-Schiff Base, Molbank, 2005, vol. 2005(4), p. M437. Modèle:DOI, article en pdf.
- ↑ W. C. Sumpter, The Chemistry of Isatin, Chemical Reviews, 1944, vol. 34(3), pp. 393–434. Modèle:DOI.
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:OrgSynth
- ↑ Modèle:Article
- ↑ Synthèse de l'isatine sur drugfuture.com.
- ↑ Modèle:Article.
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article