Acétate de palladium(II)
Modèle:Infobox Chimie L'acétate de palladium(II) est un composé organique du palladium de formule Modèle:Fchim, abrégé en [Pd(OAc)2]n. Il est plus réactif que son Modèle:Lien. En fonction de sa stœchiométrie, il existe sous deux formes différentes, aux propriétés sensiblement différentes.
Structure
Avec un ratio d'un atome de palladium pour deux ligands acétate, le composé existe sous forme moléculaire et polymérique. Le palladium prend une géométrie moléculaire plane carrée dans les deux cas.
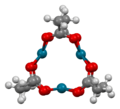
Dans sa forme préparée par Wilkinson et son équipe en 1965 et caractérisée par Skapski et Smart en 1970 par cristallographie aux rayons X, l'acétate de palladium(II) est un solide rouge-brun qui se cristallise sous forme de plaques monocliniques. Il possède une structure trimérique, les trois atomes de palladium formant un triangle équilatéral, chacun lié à deux paires de ligands acétate faisant le pont entre les atomes de palladium, dans une conformation papillon[1]Modèle:,[2]
L'acétate de palladium(II) peut aussi être préparé sous forme de poudre rose pâle. La diffraction sur poudre aux rayons X permet de dire que cette forme est polymérique[3].
-
Forme timérique
-
Forme polymérique
Synthèse
L'acétate de palladium(II) peut être préparé sous sa forme trimérique en traitant une mousse de palladium avec un mélange d'acide nitrique chaud et d'acide acétique. Le paladium doit être en excès, ou un flux de diazote doit être présent pour empêcher une contamination par le mélange nitrito-acétate (Pd3(OAc)5NO2)[4]Modèle:,[5] :
L'acétate triméique a une solubilité et une activité catalytique différente par rapport à sa variante contenant du mélange nitrate-acétate. Empêcher sa formation, ou contrôler sa quantité, est un aspect important dans le cadre d'une utilisation fiable de l'acétate de palladium(II)[6].
Le propanoate de palladium(II) est préparé de façon analogue ; les autres carboxylates sont préparés en traitant l'acétate de palladium(II) avec l'acide carboxylique approprié[1]. Inversement, l'acétate peut être préparé par traitement des autres carboxylates de palladium(II) par l'acide acétique. Cette méthode d'échange de ligand avec d'autres carboxylates purifiés est une alternative viable pour la synthèse d'acétate de palladium(II) sans contaminant nitro[6].
Chauffé en présence d'alcools, ou mis à bouillir de façon prolongée dans d'autres solvants, l'acétate de palladium(II) se décompose en palladium[1].
Utilisations
Catalyse
L'acétate de palladium est utilisé comme catalyseur dans de nombreuses réactions organiques, en particulier celles avec des alcènes, des diènes, des halogénures d'alkyle, d'aryle et de vinyle, pour former des adduits réactifs[7].
On peut citer parmi les réactions catalysées par l'acétate de palladium(II) :
- la vinylation, par exemple la réaction de Heck et les procédés proches[8] ;
- le réarrangement de diènes acycliques, par exemple le réarrangement de Cope ;
- les réactions de carbonylation, par exemple la formation d'esters à partir d'iodures d'aryle, de monoxyde de carbone, un alcool ou du phénol (molécule)[9] ;
- l'amination réductrice des aldéhydes ou cétones par le formiate de potassium[10] ;
- le procédé Wacker, c'est-à-dire l'oxydation de l'éthylène par l'eau en acétaldéhyde, précurseur du poly(acétate de vinyle).
- la réaction de Buchwald-Hartwig entre un halogénure ou pseudo-halogénure d'aryle avec une amine[11]Modèle:,[12] ;
- la conversion des bromures d'aryle en triméthylsilanes, un groupe fonctionnel présent dans de nombreux composés organiques y compris le fongicide « Latitude ».
- RC6H4Br + Si2(CH3)6 → RC6H4Si(CH3)3 + Si(CH3)3Br
Pd(O2CCH3)2 est compatible avec les propriétés électroniques de bromures d'aryle, et contrairement à d'autres méthodes de synthèse, cette méthode ne requiert pas d'équipement à haute pression[13].
Précurseur d'autres composés du palladium

L'acétate de palladium est utilisé pour produire d'autres composés du palladium(II), par exemple l'acétate de phénylpalladium utilisé pour isomériser les alcools allyliques en aldéhydes. Il est préparé de la sorte[15] :
- Hg(C6H5)(OAc) + Pd(OAc)2 → Pd(C6H5)(OAc) + Hg(OAc)2
L'acétate de palladium(II) réagit avec l'acétylacétone (le ligand « acac ») pour produire Pd(acac)2.
Il peut également servir à produire le Modèle:Lien, notamment utilisé dans la réaction de Heck. On fait pour ça réagir l'acétate avec la Modèle:Lien :
- 2 Pd(OAc)2 + 2 P(C6H4-2-CH3)3 → 2 HOAc + Pd2(OAc)2[P(C6H4-2-CH2)(C6H4-2-CH3)2]2
La lumière ou la chaleur réduisent l'acétate de palladium pour donner de couches minces de palladium. On peut se servir de cette propriété pur produire des nanofils et des colloïdes.[4]
Notes et références
Modèle:Traduction/Référence Modèle:Références
- ↑ 1,0 1,1 et 1,2 Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ 4,0 et 4,1 Modèle:Article
- ↑ Modèle:Lien web
- ↑ 6,0 et 6,1 Modèle:Article
- ↑ Suggs, J W. "Palladium: Organometallic Chemistry." Encyclopedia of Inorganic Chemistry. Ed. R B. King. 8 vols. Chichester: Wiley, 1994.
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Lien web
- ↑ Modèle:Lien web.
- ↑ Modèle:Article
- ↑ Modèle:OrgSynth