Iminoborane
Modèle:Infobox Chimie L’iminoborane est un composé chimique de formule Modèle:Nobr. Il peut se former par photolyse du borazane Modèle:Fchim[1]Modèle:,[2]Modèle:,[3]. Cette molécule est la plus simple d'une famille de composés organoborés de formule générique Modèle:Nobr également appelés iminoboranes. Ils sont électroniquement semblables aux alcynes Modèle:Nobr mais sont généralement plus réactifs en raison de leur nature polaire[4]Modèle:,[5].
La liaison entre les atomes de bore et d'azote peut être décrite par deux formes en résonance[6] :
La stabilité de ces composés est fortement affectée par la présence de substituants encombrants. L'un des iminoboranes isolables a pour structure Modèle:Nobr, avec des substituants [[tert-Butyle|Modèle:Nobr]][7].
| Molécule | Borazane[8] | Modèle:Lien[9] | Iminoborane[10] |
|---|---|---|---|
| Formule chimique | Modèle:Fchim | Modèle:Fchim | Modèle:Fchim |
| Hydrocarbure analogue et famille associée |
Éthane Alcanes |
Éthylène Alcènes |
Acétylène Alcynes |
| Structure | 
| ||
| Modèles moléculaires 3D | 
|
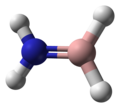
|
|
| Hybridation du bore et de l'azote | spModèle:3 | spModèle:2 | sp |
| Longueur des liaisons Modèle:Nobr | Modèle:Unité/2 | Modèle:Unité/2 | Modèle:Unité/2 |
| Longueur de liaison Modèle:Nobr | Modèle:Unité/2 | Modèle:Unité/2 | |
| Longueur de liaison Modèle:Nobr | Modèle:Unité/2 | Modèle:Unité/2 | |
| Technique de spectroscopie | Rotationnelle | Rotationnelle | Infrarouge |
Synthèse
L'une des voies de synthèse éprouvées repose sur l'élimination de fluorosilanes ou de chlorosilanes. Des substituants volumineux tels que le tris(triméthylsilyl)silane Modèle:Fchim, souvent noté Modèle:Fchim, permettent de stabiliser l'iminoborane par rapport à l'oligomérisation[11] :
La décomposition thermique des azoturoboranes Modèle:Nobr conduit à la migration d'un groupe alkyle de l'atome de bore vers l'atome d'azote pour donner l'iminoborane correspondant[12] :
- Modèle:Nobr ⟶ Modèle:Nobr + [[Diazote|Modèle:Fchim]].
Réactions
Oligomérisation
Les iminoboranes tendent à oligomériser, en formant souvant des dérivés cycliques. Les substituants volumineux ont pour vocation à bloquer ces réactions. Il se forme cinq types de produits : des cyclodimères (1,3-diaza-2,4-diboretidines[7], Di[13]), des cyclotrimères (borazines, Tr), des bicyclotrimères (borazines de Dewar, Tr’[14]), des cyclotétramères (octahydro-1,3,5,7-tétraza-2,4,6,8-tétraborocines, Te), et des polymères (polyiminoboranes, Po), représentés ci-dessous[15]. La proportion respective de ces différents types de produits dépend de la structure des réactifs et des conditions de la réaction. Certains produits peuvent s'interconvertir[16].

Réactions d'addition
La réaction d'addition des iminoboranes avec des réactifs protiques est rapide et quantitative[17]. Il est ainsi possible d'ajouter à la liaison des composés portant une liaison B–X où X représente –Cl (chloroboration), [[Azoture|Modèle:Fchim]] (azoturoboration), –SR (thioboration), Modèle:Fchim (aminoboration) et –R (alkylboration), comme illustré ci-dessous :

Certains iminoboranes riches en électrons forment des adduits avec les acides de Lewis[18].

Cycloadditions
La [2+3]-cycloaddition typique est l'addition de Modèle:Fchim sur B≡N donnant un cycle Modèle:Fchim[7]. L'une des [2+2]-cycloadditions très étudiées est la réaction des aldéhydes et des cétones.
Coordination avec les métaux de transtion
Les iminoboranes, comme les alcynes, forment des complexes avec les métaux de transition.

Notes et références
- ↑ Modèle:Article.
- ↑ Modèle:Article.
- ↑ Modèle:Article.
- ↑ Modèle:En Tristram Chivers, « Inorganic ring systems », 7th International symposium : Papers, Gordon and Breach Science Publishers, 1994 Modèle:ISBN Modèle:OCLC.
- ↑ Modèle:En Peter Paetzold, « Iminoboranes », Advances in Inorganic Chemistry, Modèle:N°, Modèle:P., Modèle:DOI Modèle:ISBN.
- ↑ Modèle:Article.
- ↑ 7,0 7,1 et 7,2 Modèle:Article.
- ↑ Modèle:Article.
- ↑ Modèle:Article.
- ↑ Modèle:Article.
- ↑ Modèle:Article.
- ↑ Modèle:Article.
- ↑ Modèle:Article.
- ↑ Modèle:Article.
- ↑ Modèle:En Harry Julius Emeléus et A. G. Sharpe, Advances in inorganic chemistry, Modèle:Vol., Academic Press, New York, 1987 Modèle:ISBN Modèle:OCLC.
- ↑ Modèle:Article.
- ↑ Modèle:Article.
- ↑ Modèle:Article.