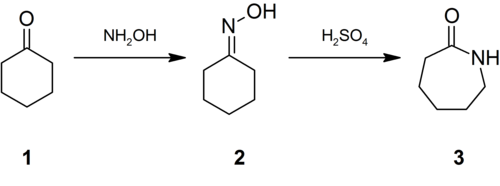Hydroxylamine
Modèle:Autre Modèle:Infobox Chimie L'hydroxylamine est un composé inorganique de formule Modèle:Fchim. Elle se présente sous la forme d'un solide cristallin blanc hygroscopique[1]. L'hydroxylamine est pratiquement toujours distribuée et utilisée sous forme de solution aqueuse. Elle est principalement, et quasi exclusivement, utilisée pour produire le Nylon 6. L'oxydation de l'ammoniac (NH3) en hydroxylamine est une étape de la nitrification[2]. L'hydroxylamine Modèle:Fchim a été détectée dans le milieu interstellaire[3].
Découverte
L'hydroxylamine a été synthétisé pour la première fois sous forme de chlorure d'hydroxylammonium en 1865 par Wilhelm Clemens Lossen, par l'action de l'étain et de l'acide chlorhydrique sur du nitrate d'éthyle[4]. Le composé a ensuite été synthétisé sous sa forme hydroxylamine en 1891 par le chimiste néerlandais Lobry de Bruyn et le chimiste français Léon Maurice Crismer.
Synthèse
Modèle:Fchim peut être synthétisé de nombreuses manières, l'un des principaux procédés est le procédé Raschig. Dans un premier temps le nitrite d'ammonium (Modèle:Fchim) est réduit par HSO3− et SO2 à 0 °C pour former un anion hydroxylamido-N,N-disulfonate
- NH4NO2 + 2 SO2 + NH3 + H2O → 2 NH4+ + N(OH)(OSO2)22−
L'anion est hydrolisé et donne (NH3OH)2SO4.
- N(OH)(OSO2)22− + H2O → NH(OH)(OSO2)− + HSO4−
- 2 NH(OH)(OSO2)− + 2 H2O → Modèle:Chem + Modèle:Chem
On récupère ensuite Modèle:Fchim solide par un lavage à l'ammoniac liquide. Le sulfate d'ammonium(un sous-produit), n'est pas soluble dans l'ammoniac liquide, il est donc éliminé par filtration, le produit désiré est ensuite obtenu en évaporant le solvant.
Équation bilan du procédé Raschig:
- 2Modèle:Chem− + 4Modèle:Chem + 6Modèle:Chem + 6Modèle:Chem → 4Modèle:Chem2− + 6Modèle:Chem+ + 2Modèle:Chem
L'Hydroxylamine peut être obtenu à partir de sels d'hydroxylamine par neutralisation:
- (NH3OH)Cl + NaOBu → NH2OH + NaCl + BuOH [1]
D'autres méthodes permettent de synthétiser l'hydroxylamine. L'une d'elles a été découverte par Julius Tafel. Il s'agit de faire l'électrolyse de l'acide nitrique en présence de HCl ou d'acide sulfurique[5].
- HNO3 + 3H2 → NH2OH + 2H2O
Une autre méthode consiste à réduire l'acide nitrique ou le nitrate de potassium par du bisulfite.
- HNO2 + 2 HSO3− → N(OH)(OSO2)22− + H2O → NH(OH)(OSO2)− + HSO4−
- NH(OH)(OSO2)− + H3O+ (Modèle:Tmp/1 h) → NH3(OH)+ + HSO4−
Réactivité
L'hydroxylamine réagit, en chimie organique, essentiellement en tant que nucléophile. La fonction alcool (respectivement la fonction amine) est plus nucléophiles qu'une fonction alcool normale (respectivement qu'une fonction amine normale). Ceci est dû à l'effet alpha[6].
Par exemple il peut réagir sur les halogénoalcanes :
- R-X + NH2OH → R-ONH2 + HX
- R-X + NH2OH → R-NHOH + HX
L'hydroxylamine peut également réagir sur les cétones ou les aldéhydes et donne des oximes.
- R2C=O + NH2OH∙HCl , NaOH → R2C=NOH + NaCl + H2O
Les oximes sont des composés intéressants car contrairement aux imines ces composés sont stables[6].
- R2C=O + NH2OH∙HCl , NaOH → R2C=NOH + NaCl + H2O
Cette réaction est très utilisée pour purifier les aldéhydes ou les cétones. L'oxime formée est en général peu soluble et elle précipite. Il suffit ensuite de la chauffer en présence d'acide pour reformer l'aldéhyde ou la cétone de départ[7].
Les oximes sont également utilisées comme ligand.
D'autres réactions sont utilisées, par exemple la synthèse de l'acide d'hydroxylamine-O-sulfonique, un intermédiaire important dans la synthèse du caprolactame, monomère du nylon
- HOSO2Cl + NH2OH → NH2OSO2OH + HCl
L'hydroxylamine ou les hydroxylamines(R-NHOH) à chaînes carbonées peuvent être réduits en amines[8].
- NH2OH (Zn/HCl) → NH3
- R-NHOH (Zn/HCl) → R-NH2
L'hydroxylamine est un composé explosif. Il explose s'il est chauffé, selon la réaction suivante:
- 4 NH2OH + O2 → 2 N2 + 6 H2O
Utilisations
L'hydroxylamine et ses sels sont utilisés dans de nombreuses réactions chimiques en tant qu'agents réducteurs. Ils servent aussi d'antioxydants pour les acides gras.
La synthèse industrielle du nylon utilise la réaction de l'hydroxylamine sur la cyclohexanone (1) pour donner l'oxime (2) qui subit un réarrangement de Beckman en milieu acide pour donner le caprolactame (3)
De nombreuses recherches sont conduites sur le nitrate d'hydroxylammonium pour faire de lui un agent propulseur dans les fusées. L'hydroxylamine a en effet une structure proche de l'hydrazine déjà utilisé.
L'hydroxylamine a également beaucoup été utilisée par les biologistes dans l'étude des protéines. Ce composé permet d'introduire des mutations dans l'ADN, des mutations G→A ou C→T. Cela permet aux biologistes d'étudier les différents mécanismes de réparation au sein de la cellule. L'hydroxylamine a depuis été remplacé en biologie par des agents mutagènes plus performants. L'hydroxylamine, en revanche, peut cliver sélectivement la liaison asparagine-glycine au sein des protéines. Ce composé se fixe sur les hèmes de manière irréversible, il agit donc comme un poison dans le sang. Il peut aussi inhiber la photosynthèse, il échange sa place avec l'eau et bloque le mécanisme.
Une méthode de synthèse du paracétamol utilise l'hydroxylamine. Il s'agit de la synthèse de Hoechst-Celanese, elle utilise la réaction de l'hydroxylamine sur une cétone.
L'hydroxylamine a d'autres utilisations non-chimiques. Il est utilisé pour retirer des poils sur des peaux d'animaux. L'hydroxylamine peut aussi servir dans le développement des photos.
Dangerosité
L'hydroxylamine est un composé potentiellement explosif s'il est chauffé. Plusieurs usines ont connu des incidents relatifs au stockage de l'hydroxylamine, l'une des dernières explosions a eu lieu en 2000 à Ojima au Japon, l'explosion a coûté la vie à quatre personnes et en a blessé cinquante-huit autres[9]. En présence d'ions ferreux ou ferriques cette décomposition est accélérée de 50%[10]. L'hydroxylamine peut être stockée sous forme de sels, les risques d'explosion étant alors moins élevés.
Références
- ↑ 1,0 et 1,1 Greenwood and Earnshaw. Chemistry of the Elements. 2nd Edition. Reed Educational and Professional Publishing Ltd. pp. 431–432. 1997.
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ W. C. Lossen (1865) "Ueber das Hydroxylamine" (On hydroxylamine), Zeitschrift für Chemie, 8 : 551-553. From p. 551: "Ich schlage vor, dieselbe Hydroxylamin oder Oxyammoniak zu nennen."
- ↑ Modèle:Ouvrage
- ↑ 6,0 et 6,1 Stijn M.Agten, Philip E. Dawson, Tilman M. Hackeng Oxime conjugation in protein chemistry: from carbonyl incorporation to nucleophilic catalysis, 23 mars 2013, http://onlinelibrary.wiley.com/doi/10.1002/psc.2874/full
- ↑ Ralph Lloyd Shriner, Reynold C. Fuson, and Daniel Y. Curtin, The Systematic Identification of Organic Compounds: A Laboratory Manual, Modèle:5th ed. (New York: Wiley, 1964), chapter 6.
- ↑ Smith, Michael and Jerry March. March's advanced organic chemistry : reactions, mechanisms, and structure. New York. Wiley. Modèle:P.. 2001.
- ↑ http://www.sozogaku.com/fkd/en/hfen/HC1000050.pdf
- ↑ Modèle:Article