Oxydation de Pinnick
LModèle:'oxydation de Pinnick est une réaction de chimie organique consistant en une oxydation d'un aldéhyde en l'acide carboxylique correspondant. Elle est mise au point en 1981 par Harold Pinnick à partir des travaux de Lindgren et Kraus[1].
Le réactif oxydant est le chlorite de sodium et l'ajout au milieu réactionnel de 2-méthylbut-2-ène permet d'éviter la suroxydation du substrat[1]. La réaction est menée en présence d'un tampon de dihydrogénophosphate de sodium[1].
Mécanisme
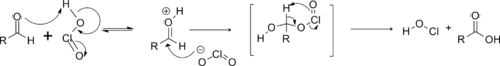
Le mécanisme réactionnel commence par la formation d'acide chloreux par réaction entre le chlorite et le dihydrogénophosphate[1].
L'acide chloreux protone ensuite l'aldéhyde, ce qui accentue l'électrophilie de son carbone fonctionnel, qui subit alors une attaque nucléophile par l'ion chlorite libéré. Un mécanisme concerté permet l'élimination de l'acide hypochloreux et la formation de l'acide carboxylique souhaité[1].
Réactions secondaires
L'acide hypochloreux créé lors de la réaction est responsable de deux réactions secondaires.
Dans la première, il réagit avec les ions chlorite pour former du dioxyde de chlore et des ions chlorure.
L'acide hypochloreux est un oxydant plus fort que l'ion chlorite[2]. Il va donc avoir tendance à oxyder d'autres fonctions du substrat que la fonction aldéhyde. Pour éviter cette suroxydation, on ajoute au milieu un excès de 2-méthylbut-2-ène[1].

Utilisations
L'utilisation du 2-méthylbut-2-ène permet d'oxyder une large gamme de substrats insaturés sans attaquer les doubles liaisons carbone-carbone, même dans le cas d'aldéhydes α,β-insaturés[1]. Les groupes hydroxyle[1], époxyde, éther de benzyle, halogénures et stannanes sont stables dans les conditions de la réaction[2]Modèle:,[3]Modèle:,[4]Modèle:,[5].
L'éventuel centre stéréogène en α du carbonyle n'est pas modifié par la réaction[1]. Cette propriété a été exploitée lors de synthèses totales de molécules contenant des centres stéréogènes en α des fonctions à oxyder. C'est par exemple le cas dans la synthèse de la ditryptophénaline par Overman en 2001, où un alcool est transformé en acide carboxylique par l'enchainement d'une oxydation de Dess-Martin et d'une oxydation de Pinnick[1] ou dans la synthèse de l'acide zaragozique pour laquelle une oxydation de Swern précède l'oxydation de Pinnick[1]. Dans ce dernier exemple, d'autres réactions d'oxydation, comme l'oxydation de Jones ou l'oxydation de Ley, ont été tentées, sans succès[1].
Notes et références
Modèle:Traduction/Référence Modèle:Références
Bibliographie
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 et 1,11 Erreur de référence : Balise
<ref>incorrecte : aucun texte n’a été fourni pour les références nomméesK - ↑ 2,0 et 2,1 Erreur de référence : Balise
<ref>incorrecte : aucun texte n’a été fourni pour les références nomméesDalcanale - ↑ Erreur de référence : Balise
<ref>incorrecte : aucun texte n’a été fourni pour les références nomméesAlcohols - ↑ Modèle:Article.
- ↑ Erreur de référence : Balise
<ref>incorrecte : aucun texte n’a été fourni pour les références nomméesReview