Dioxyde de silicium
Le dioxyde de silicium, ou silice, est un composé de l'oxygène et du silicium, de formule Modèle:Fchim. C'est l'Modèle:Page h' le plus courant, avec pour le silicium le nombre d'oxydation +IV et pour l'oxygène −II.
À l'état solide il est présent en abondance dans le milieu naturel et chez divers êtres vivants, sous différentes formes cristallines ou amorphes, incolores. On le trouve aussi combiné à d'autres oxydes dans les silicates, qui sont les principaux constituants de l'écorce terrestre et du manteau terrestre. Libre ou combiné, il représente 60,6 % de la masse de la croûte continentale[1]. Il est particulièrement abondant sous forme de quartz, notamment dans les granites. Il existe également sous forme de matériau synthétique, comme le verre de quartz, la silice pyrogénée, le gel de silice et les aérogels. Il est utilisé comme matériau structurel, en microélectronique, comme isolant électrique, ainsi que comme ingrédient pour l'industrie pharmaceutique et l'industrie agroalimentaire.
L'inhalation de silice cristallisée finement divisée est toxique et peut conduire à des inflammations graves des poumons, à la silicose, à des bronchites, au cancer du poumon et à des maladies auto-immunes comme le lupus érythémateux disséminé et la polyarthrite rhumatoïde. L'absorption de dioxyde de silicium amorphe a été déclarée ne provoquer que de brèves inflammations réversibles[2], mais les dernières recherches semblent infirmer cette affirmation, et l'ANSES appelle à "un encadrement réglementaire renforcé" de toutes les nanoparticules[3].
Propriétés physiques
Diagramme de phases

Dans les conditions normales de température et de pression (T = Modèle:Tmp, P = Modèle:Unité), le dioxyde de silicium à l'équilibre est sous la forme de quartz α, un matériau cristallin de structure trigonale (Z = 3 motifs SiOModèle:Ind par maille).
À basse pression (P < Modèle:Unité) et température T croissante, la phase stable est successivement :
- le quartz α, trigonal (Z = 3) ;
- le quartz β, hexagonal (Z = 4) ;
- la tridymite, triclinique (Z = 320[alpha 1]) ;
- la cristobalite, tétragonale (Z = 4) ;
- la silice liquide (à partir de Modèle:Tmp à pression atmosphérique) ;
- la vapeur de silice (au-dessus de Modèle:Tmp à pression atmosphérique).
Modèle:Clr À basse température (T < Modèle:Tmp) et pression P croissante, la phase stable est successivement :
- le quartz α, trigonal (Z = 3) ;
- la coésite, monoclinique (Z = 16) ;
- la stishovite, tétragonale (Z = 2).
Les transitions de phase du diagramme sont du premier ordre, à l'exception de la transition Modèle:Nobr Modèle:Nobr (du deuxième ordre), qui est displacive (elle se fait par simple déplacement des atomes sans rupture de liaisons chimiques) ; pour cette raison elle ne nécessite pas de nucléation, et le Modèle:Nobr ne peut pas être trempé à basse température.
Dans toutes les phases ci-dessus chaque atome de silicium est au centre d'un tétraèdre [[[:Modèle:Fchim]]], à l'exception de la vapeur de silice (molécules Modèle:Fchim) et de la stishovite, dans laquelle le nombre de coordination du silicium est 6 (octaèdres [[[:Modèle:Fchim]]]).
Formes cristallines
Le dioxyde de silicium est un solide incolore relativement dur (7,0 sur l'échelle de Mohs pour le quartz) qui existe aussi bien sous forme cristallisée que sous forme amorphe. Sa masse volumique vaut Modèle:Unité pour le quartz α, mais Modèle:Unité pour le Modèle:Fchim amorphe[5]. Il est transparent dans tout le spectre visible, d'où ses applications en optique, avec un indice de réfraction voisin de 1,46. Il est en revanche moins transparent dans l'infrarouge, ce qui explique en partie l'avantage procuré en horticulture par l'emploi de serresModèle:Note. C'est un bon isolant électrique, avec une résistivité de Modèle:Unité pour les formes cristallisées, et supérieure à Modèle:Unité pour les formes amorphes[6]. Sa conductivité thermique vaut respectivement Modèle:Unité, et son coefficient de Poisson respectivement 0,17 et 0,165 pour les formes cristallines et amorphes.
Dans la majorité des silicates, les atomes de silicium présentent une coordination tétraédrique, avec quatre atomes d'oxygène entourant un atome de silicium central. Les polymorphes du quartz sont des exemples de telles structures, qui forment un réseau tridimensionnel dans lequel chaque atome de silicium est lié par covalence à quatre atomes d'oxygène de manièe tétraédrique.
Par exemple, dans la maille cristalline du quartz α, le tétraèdre central partage ses quatre sommets, formés chacun d'un atome d'oxygène, tandis que les deux tétraèdres à faces centrées partagent deux de leurs quatre sommets, et que les quatre tétraèdres à arêtes centrées ne partagent que l'un de leurs atomes d'oxygène avec des tétraèdres Modèle:Fchim voisins. Ce sont ainsi 12 atomes d'oxygène sur les 24 que comptent les 7 tétraèdres de la maille élémentaire du quartz α qui sont partagés entre deux tétraèdres adjacents.
La seule forme stable de dioxyde de silicium aux conditions normales de température et de pression est le quartz α, qui est la forme cristalline la plus commune du Modèle:Fchim. Les impuretés dans le réseau du cristal peuvent donner à ce dernier différentes couleurs. La transition entre le quartz α et le quartz β se produit à Modèle:Tmp de manière abrupte. Comme cette transition s'accompagne d'une augmentation sensible du volume du cristal, elle peut aisément fracturer les roches ou les céramiques contenant du dioxyde de silicium franchissant cette température[7].
Minéraux des hautes températures, la cristobalite et la tridymite ont une masse volumique et un indice de réfraction inférieurs à ceux du quartz α. En revanche, la seifertite, la stishovite et la coésite, qui sont des minéraux des hautes pressions, ont une masse volumique et un indice de réfraction supérieurs à ceux du quartz α[8].
Hormis la stishovite et les fibres de silice, tous les polymorphes du dioxyde de silicium cristallisé sont constitués de tétraèdres Modèle:Fchim unis par certains de leurs sommets dans différentes configurations tridimensionnelles. La longueur de la liaison Si–O varie selon les formes cristallines. Dans le quartz α, par exemple, elle vaut Modèle:Unité/2, tandis qu'elle vaut de Modèle:Unité/2 dans la tridymite α. L'angle de liaison Si–O–Si varie également de 140° pour la tridymite α à 180° pour la tridymite β, tandis qu'il vaut 144° pour le quartz α[9].
Les fibres de silice présentent une structure semblable à celle du disulfure de silicium Modèle:Fchim, avec des chaînes de tétraèdres partageant certaines de leurs arêtes. La stishovite, forme stable à haute pression, présente en revanche une structure de type rutile, dans laquelle les atomes de silicium sont hexacoordonnés. La masse volumique de la stishovite est de Modèle:Unité/2, bien supérieure à celle du quartz α, qui n'est que de Modèle:Unité/2[10]. Cette différence de masse volumique est à mettre en relation avec la variation de coordinence, car les liaisons Si–O sont plus longues dans la stishovite — quatre liaisons équatoriales de Modèle:Unité/2 et deux liaisons polaires de Modèle:Unité/2 — que dans le quartz α : quatre liaisons tétraédriques de Modèle:Unité/2[11].
La faujasite est une autre forme de silice cristalline. On l'obtient par désalumination de zéolithes Y ultra stables à basse teneur en sodium à l'aide d'un traitement thermique en présence d'un acide. Le produit résultant contient plus de 99 % de silice ayant une forte cristallinité et une surface spécifique élevée (plus de Modèle:Unité/2). C'est un matériau très stable vis-à-vis de la température et des acides. Il conserve notamment se cristallinité et son haut degré d'ordre moléculaire à grande distance après avoir été placé dans de l'acide chlorhydrique concentré bouillant[12].
| Polymorphe | Structure | Système, Pearson, Modèle:N° de groupe d'espace |
ρ g·cmModèle:Exp |
Remarques |
|---|---|---|---|---|
| Quartz α | 
|
Trigonal rhomboédrique hP9, P3Modèle:Ind21 Modèle:N°[13] |
2,648 | Chaînes hélicoïdales rendant les monocristaux optiquement actifs. Le quartz α se transforme en quartz β à Modèle:Unité/2. |
| Quartz β | 
|
Hexagonal hP18, P6Modèle:Ind22, Modèle:N°[14] |
2,533 | Étroitement apparenté au quartz α, avec un angle Si–O–Si de 155° et optiquement actif. Le quartz β se transforme en tridymite β à Modèle:Unité/2. |
| Tridymite α | 
|
Orthorhombique oS24, C222Modèle:Ind, Modèle:N°[15] |
2,265 | Métastable à pression atmosphérique. |
| Tridymite β | 
|
Hexagonal hP12, P6Modèle:Ind/mmc, Modèle:N°[15] |
Étroitement apparentée à la tridymite α. La tridymite β se transforme en cristobalite β à Modèle:Unité/2. | |
| Cristobalite α | 
|
Tétragonal tP12, P4Modèle:Ind2Modèle:Ind2, Modèle:Ind[16] |
2,334 | Métastable à pression atmosphérique. |
| Cristobalite β | 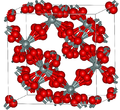
|
Cubique cF104, FdModèle:Surlignerm, Modèle:N°[17] |
Étroitement apparentée à la cristobalite α. Fond à Modèle:Unité/2. | |
| Keatite | 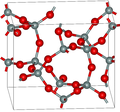
|
Tétragonal tP36, P4Modèle:Ind2Modèle:Ind2, Modèle:N°[18] |
3,011 | Cycles Modèle:Fchim, Modèle:Fchim et Modèle:Fchim. Produit à partir de verre de quartz et d'alcalis de Modèle:Unité/2 et de Modèle:Unité/2. |
| Moganite | 
|
Monoclinique mS46, C2/c, Modèle:N°[19] |
Cycles Modèle:Fchim et Modèle:Fchim. | |
| Coésite | 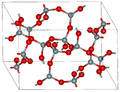
|
Monoclinique mS48, C2/c, Modèle:N°[20] |
2,911 | Cycles Modèle:Fchim and Modèle:Fchim. Formation à Modèle:Unité/2 et de Modèle:Unité/2. |
| Stishovite | 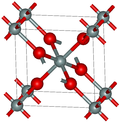
|
Tétragonal tP6, P4Modèle:Ind/mnm, Modèle:N°[21] |
4,287 | L'une des formes de dioxyde de silicium les plus denses, de masse volumique à peine inférieure à celle de la seifertite. Structure cristalline de type rutile avec du silicium hexacoordonné. Formation de Modèle:Unité/2. |
| Seifertite | 
|
Orthorhombique oP, Pbcn[22] |
4,294 | L'une des formes de dioxyde de silicium les plus denses, de masse volumique légèrement supérieure à celle de la stishovite. Elle se forme à des pressions supérieures à Modèle:Unité/2[23]. |
| Mélanophlogite | 
|
Cubique (cP*, P4Modèle:Ind32, Modèle:N°)[24] ou tétragonal (P4Modèle:Ind/nbc)[25] | 2,04 | Cycles Modèle:Fchim, Modèle:Fchim. Présent avec des hydrocarbures dans les espaces interstitiels[26]. |
| Silice fibreuse[10] | 
|
Orthorhombique oI12, Ibam, Modèle:N°[27] |
1,97 | Structure semblable à celle du disulfure de silicium Modèle:Fchim constituée de chaînes de tétraèdres Modèle:Fchim unis par certaines de leurs arêtes. Il fond à environ Modèle:Unité/2 |
| Silice 2D[28] | 
|
Hexagonal | Structure en bicouches de feuillets de silice hexagonale. |
Formes non cristallines ou biologiques
Il existe une grande variété de minéraux constitués d'une fraction plus ou moins importante de Modèle:Fchim amorphe. Le principal d'entre eux est l'opale, qui est un hydrate de dioxyde de silicium amorphe dont l'eau représente généralement entre 6 et 10 % de la masse, les valeurs extrêmes allant de 3 à 21 %. La geysérite est une variante d'opale formée autour des sources chaudes et des geysers.
Certaines roches siliceuses sont d'origine biologique, comme les radiolarites et les diatomites, comme le kieselguhr, formées par diagenèse à partir de squelettes de myriades de radiolaires, de frustules de diatomées, d'éponges siliceuses, voire de thèques d'amibes testacées[29]. D'autres, comme le silex et le grès, sont des roches sédimentaires plus ou moins cristallines, le silex étant généralement qualifié de cryptocristallin tant ses cristaux de quartz sont petits et agencés de manière désordonnée.
De la silice amorphe se forme également à partir de silice cristalline fondue et refroidie rapidement. On en trouve ainsi dans diverses roches volcaniques, comme l'obsidienne et la tachylite, ou encore dans les éjectas issus de cratères d'impacts, comme les tectites. Une variété particulière de telles roches se forme à partir de sols siliceux frappés par la foudre : les fulgurites et la lechateliérite.
Les plantes produisent des phytolithes dont certains sont constitués de dioxyde de silicium. Dans la mesure où les phytolithes riches en Modèle:Fchim, qui favorisent l'usure des dents et des mandibules, se rencontrent notamment dans les herbes consommées comme pâturage (graminées) par divers herbivores allant des insectes aux ongulés, on pense qu'il s'agit d'un mécanisme de défense développé par ces plantes pour limiter leur consommation[30]Modèle:,[31]. On trouve également de la silice dans les cendres de balle de riz, qui peut être utilisée en filtration et dans la fabrication de ciments.
Du Modèle:Fchim moléculaire à géométrie moléculaire linéaire O=Si=O est produit lorsque du monoxyde de silicium SiO est condensé dans une matrice d'argon cryogénique refroidie à l'hélium liquide en présence d'atomes d'oxygène libérés par décharge micro-onde. Du dioxyde de silicium dimérique Modèle:Fchim a été obtenu en faisant réagir des molécules d'oxygène Modèle:Fchim avec du monoxyde de silicium dimérique Modèle:Fchim. Le dioxyde de silicium dimérique présente deux atomes d'oxygène pontants entre les atomes de silicium avec un angle Si–O–Si de 94° et une longueur de liaison de Modèle:Unité/2, tandis que la liaison Si–O terminale a une longueur de Modèle:Unité/2.
Silice liquide
À l'état liquide, le dioxyde de silicium présente certaines propriétés semblables à celles de l'eau, comme un coefficient de dilatation thermique négatif, un maximum de masse volumique autour de Modèle:Tmp, ainsi qu'un minimum de capacité thermique[32]. Sa masse volumique décroît de Modèle:Unité/2 à Modèle:Tmp jusqu'à Modèle:Unité/2 à Modèle:Tmp[33].
Propriétés chimiques
La solubilité du dioxyde de silicium dans l'eau dépend fortement de sa forme cristalline. Elle est bien plus élevée pour la silice amorphe que pour le quartz — Modèle:Unité/2 à Modèle:Tmp respectivement[34] — et est maximum à Modèle:Tmp avec Modèle:Unité/2 à pression de vapeur saturante[35] ; cette propriété est mise à profit pour faire croître des monocristaux de quartz par procédé hydrothermal dans lequel du quartz naturel est dissous dans de l'eau surchauffée dans un récipient pressurisé qui est refroidi par le haut : on peut obtenir des cristaux de Modèle:Unité sur une période de un à deux mois[9]. De tels cristaux de quartz très purs peuvent être utilisés pour des applications électroniques[10]. La solubilité du Modèle:Fchim est encore plus élevée dans l'eau supercritique, atteignant 20 % à Modèle:Tmp et Modèle:Unité.
Le Modèle:Fchim dissous dans l'eau forme un acide silicique Modèle:Fchim, qui est un acide faible, avec un maximum de Modèle:Unité/2 à Modèle:Tmp dans l'eau purifiée. Cette valeur augmente avec la température, la pression, mais aussi le pH, les solutions basiques favorisent en effet la formation d'ions silicate Modèle:FchimModèle:Exp. L'acide silicique forme des suspensions colloïdales dans l'eau en lui conférant une certaine opacité. C'est le cas dans l'eau des geysers, comme celui de Geysir en Islande. Pour une concentration donnée en silice colloïdale, la couleur bleue est d'autant plus intense que l'eau est plus froide, la solubilité de l'acide silicique y étant alors plus faible.
Le dioxyde de silicium peut donner du silicium par réaction carbothermique dans des fours à arc à plus de Modèle:Tmp selon la réaction :
- Modèle:Fchim + 2 C ⟶ Si + 2 CO.
Le fluor Modèle:Fchim réagit avec le dioxyde de silicium pour former du tétrafluorure de silicium Modèle:Fchim en libérant de l'oxygène Modèle:Fchim, tandis que les autres halogènes (chlore Modèle:Fchim, brome Modèle:Fchim et iode Modèle:Fchim) ne réagissent pas avec lui[10].
Le dioxyde de silicium est attaqué par l'acide fluorhydrique HF pour donner de l'acide hexafluorosilicique[9] Modèle:Fchim, réaction utilisée notamment dans l'industrie des semi-conducteurs pour graver ou retirer des couches minces de Modèle:Fchim :
- Modèle:Fchim + 6 [[Acide fluorhydrique|HFModèle:Ind]] ⟶ [[Acide hexafluorosilicique|Modèle:Fchim]] + 2 [[Eau|Modèle:Fchim]].
Le dioxyde de silicium est un oxyde acide au sens de Lux-Flood, qui réagit avec les oxyde basiques pour donner des silicates, par exemple sous forme d'ions métasilicate Modèle:FchimModèle:Exp, analogues à l'ion carbonate Modèle:FchimModèle:Exp, et orthosilicate Modèle:FchimModèle:Exp. Ainsi, l'oxyde de calcium CaO réagit avec le dioxyde de silicum et donne des silicates de calcium, par exemple de la wollastonite Modèle:Fchim :
- CaO + Modèle:Fchim ⟶ [[Silicate de calcium|Modèle:Fchim]].
La présence ubiquitaire de silicates parmi les minéraux fait du silicium le deuxième élément chimique le plus abondant de l'écorce terrestre, après l'oxygène.
Le dioxyde de silicium est dissous dans les bases concentrées à chaud ou les hydroxydes de métaux alcalins fondus, comme le montre par exemple cette équation idéalisée :
- Modèle:Fchim + 2 NaOH ⟶ [[Silicate de sodium|Modèle:Fchim]] + [[Eau|Modèle:Fchim]].
Le dioxyde de silicium neutralise les oxydes métalliques basiques comme l'oxyde de sodium Modèle:Fchim, l'oxyde de potassium Modèle:Fchim, l'oxyde de plomb(II) PbO ou l'oxyde de zinc ZnO, formant des silicates et des verres alors que les liaisons Si–O–Si sont progressivement rompues[9]. Ainsi, la réaction de l'oxyde de sodium et du dioxyde de silicium peut produire de l'orthosilicate de sodium Modèle:Fchim, du silicate de sodium Modèle:Fchim et des verres, selon les proportions des réactifs :
- 2 [[Oxyde de sodium|Modèle:Fchim]] + Modèle:Fchim ⟶ [[orthosilicate de sodium|Modèle:Fchim]] ;
- [[Oxyde de sodium|Modèle:Fchim]] + Modèle:Fchim ⟶ [[Silicate de sodium|Modèle:Fchim]] ;
- (0,25–0,8) [[Oxyde de sodium|Modèle:Fchim]] + Modèle:Fchim ⟶ verre.
Certains de ces verres ont une importance commerciale, par exemple le verre sodocalcique (avec du carbonate de sodium Modèle:Fchim et de l'oxyde de calcium CaO), le verre borosilicate (avec du carbonate de sodium Modèle:Fchim et du sesquioxyde de bore Modèle:Fchim) et le cristal (avec de l'oxyde de plomb(II) PbO).
Le dioxyde de silicium réagit à chaud avec le silicium pour donner du monoxyde de silicium SiO :
- Modèle:Fchim + Si ⟶ 2 SiO.
Cycle biogéochimique de la silice
Modèle:Article détaillé Parmi les services écosystémiques fournis par les éponges siliceuses (et les radiolaires), figure leur rôle dans le cycle océanique de la silice. Alors que l'océan reçoit en continu de la silice d'origine terrigène, l'enfouissement des squelettes siliceux (forme particulièrement insoluble de la silice biogénique) joue un rôle majeur dans le cycle biogéochimique de la silice océanique[36].
On a longtemps cru que le cycle marin du Si était à l'équilibre grâce à l'enfouissement de squelettes siliceux d'algues (diatomées) ou à leur transformation en argile authigénique (phénomène d'altération inverse), mais il a été démontré que les glaciers et eaux souterraines apportent un surplus de silice à l'océan mondial[36]. La digestion chimique d'échantillons de sédiments et leur examen au microscope montrent que le rôle de l'enfouissement de squelettes insolubles d'éponges a été très sous-estimé dans les inventaires biogéochimiques. Les éponges siliceuses sont maintenant considérées comme étant le premier puits de silice marin[36].
Production
Le dioxyde de silicium provient essentiellement de l'exploitation minière, y compris de l'extraction de sable et de la purification du quartz.
Fumée de silice
La fumée de silice est obtenue comme sous-produit de procédés à chaud comme la production de ferrosilicium. Elle est moins pure que la silice pyrogénée et ne doit pas être confondue avec elle, ses propriétés physiques et ses applications étant également différentes.
Silice pyrogénée
La silice pyrogénée est une forme de silice pulvérulente ou colloïdale obtenue en faisant brûler du tétrachlorure de silicium Modèle:Fchim dans une flamme d'hydrogène Modèle:Fchim riche en oxygène[10] Modèle:Fchim :
- [[Tétrachlorure de silicium|Modèle:Fchim]] + 2 [[Dihydrogène|Modèle:Fchim]] + [[Dioxygène|Modèle:Fchim]] ⟶ Modèle:Fchim + 4 HCl.
Silice précipitée
La silice précipitée est une forme amorphe de dioxyde de silicium obtenue par acidification de solutions de silicate de sodium Modèle:Fchim. Il se forme un précipité gélatineux, ou gel de silice, d'abord lavé puis déshydraté pour donner de la silice microporeuse[10]. L'équation idéalisée faisant intervenir un trisilicate de sodium Modèle:Fchim et l'acide sulfurique Modèle:Fchim peut être résumée ainsi :
- Modèle:Fchim + [[Acide sulfurique|Modèle:Fchim]] ⟶ 3 Modèle:Fchim + [[Sulfate de sodium|Modèle:Fchim]] + [[Eau|Modèle:Fchim]].
De l'ordre d'un million de tonnes de silice ont été produits de cette manière en 1999, destinés essentiellement à l'utilisation dans des matériaux composites (pneus et semelles de chaussures)[37].
Sur circuits intégrés
Des couches minces de dioxyde de silicium se développent spontanément sur les Modèle:Lang de silicium par oxydation thermique, en donnant une couche très fine d'environ Modèle:Unité/2 d'oxyde natif[38]. Il est possible de faire croître des couches de dioxyde de silicium sur du silicium, par exemple à des températures de Modèle:Tmp en utilisant de l'oxygène (oxydation sèche) ou de l'eau (oxydation humide)[39]Modèle:,[40] :
- Si + [[Dioxygène|Modèle:Fchim]] ⟶ Modèle:Fchim ;
- Si + 2 [[Eau|Modèle:Fchim]] ⟶ Modèle:Fchim + 2 [[Dihydrogène|Modèle:Fchim]].
Cette couche d'oxyde natif est utile en microélectronique car elle agit comme isolant électrique avec une grande stabilité chimique. Elle peut protéger le silicium, permettre d'accumuler une charge électrique (condensateur), bloquer le courant électrique, voire réguler l'intensité du courant.
Procédés particuliers ou de laboratoire
De nombreux procédés aboutissant au dioxyde de silicium partent de composés organosiliciés comme l'hexaméthyldisiloxane[41] Modèle:Fchim (HMDSO) et l'orthosilicate de tétraéthyle Modèle:Fchim (TEOS). Ainsi, le simple chauffage du TEOS de Modèle:Tmp donne du dioxyde de silicium :
- [[Orthosilicate de tétraéthyle|Modèle:Fchim]] ⟶ Modèle:Fchim + 2 [[Éther diéthylique|Modèle:Fchim]].
De même, le TEOS brûle vers Modèle:Tmp :
- [[Orthosilicate de tétraéthyle|Modèle:Fchim]] + 12 [[Dioxygène|Modèle:Fchim]] ⟶ Modèle:Fchim + 10 [[Eau|Modèle:Fchim]] + 8 [[Dioxyde de carbone|Modèle:Fchim]].
Le TEOS est hydrolysé par procédé sol-gel. Le déroulement de la réaction et la nature du produit dépendent des catalyseurs, mais l'équation idéalisée peut s'écrire[42] :
- [[Orthosilicate de tétraéthyle|Modèle:Fchim]] + 2 [[Eau|Modèle:Fchim]] ⟶ Modèle:Fchim + 4 [[Éthanol|Modèle:Fchim]].
Le dioxyde de silicium étant un composé très stable, il apparaît au cours de nombreuses réactions chimiques. Ainsi, la combustion du silane Modèle:Fchim donne du dioxyde de silicium de la même manière que la combustion du méthane Modèle:Fchim donne du dioxyde de carbone Modèle:Fchim :
- [[Silane (composé)|Modèle:Fchim]] + 2 [[Dioxygène|Modèle:Fchim]] ⟶ Modèle:Fchim + 2 [[Eau|Modèle:Fchim]].
Le dépôt chimique en phase vapeur (Modèle:Abréviation) de Modèle:Fchim à la surface de cristaux à partir de silane a été réalisé dans un flux d'azote Modèle:Fchim à une température de Modèle:Tmp[43].
Applications
Utilisations structurelles
De l'ordre de 95 % du dioxyde de silicium (sable) produit est consommé dans l'industrie du BTP, par exemple pour la production de béton de ciment (ciment Portland)[37]. Le dioxyde de silicium est le principal composant des moulages en sable utilisés pour la réalisation de pièces métalliques en ingénierie et autres applications technologiques. Le point de fusion élevé de la silice est particulièrement utile dans cet usage.
La silice cristallisée est utilisée en fracturation hydraulique de formations géologiques contenant du pétrole de réservoirs étanches et du gaz de schiste.
Production de verre et de silicium
La silice est la principale matière première utilisée pour la production de la plupart des verres. La température de transition vitreuse du dioxyde de silicium pur est d'environ Modèle:Tmp[44]. Lorsque du dioxyde de silicium fondu est refroidi rapidement, il ne cristallise pas mais se solidifie sous forme d'un solide amorphe, en l'occurrence un verre. L'absence d'ordre à grande distance n'implique pas que le matériau soit également désordonné à plus petite échelle, et on observe une organisation ordonnée dans la silice amorphe à des échelles qui dépassent largement la longueur de la liaison Si–O ; c'est par exemple le cas des cycles de six tétraèdres Modèle:Fchim[45].
La plus grande partie des fibres optiques destinées aux télécommunications sont en dioxyde de silicium. Ce dernier est la matière première de nombreuses céramiques, comme la terre cuite, les grès et la porcelaine.
Le dioxyde de silicium permet d'obtenir du silicium pur, par un procédé faisant intervenir une réaction carbothermique dans un four à arc électrique[46] :
- Modèle:Fchim + 2 C ⟶ Si + 2 CO.
Industrie électronique
Le dioxyde de silicium est également très utilisé dans l'industrie de la microélectronique où il sert comme couche de passivation, d'oxyde (diélectrique) de grille pour transistor MOSFET ou encore comme couche anti-reflet. Ses applications sont semblables à celles d'autres oxydes apparentés, comme le dioxyde de zirconium Modèle:Fchim, le dioxyde de titane Modèle:Fchim ou encore l'oxyde d'hafnium(IV) Modèle:Fchim.
Utilisations agroalimentaires
Le dioxyde de silicium est un additif (E 551) couramment utilisé dans l'industrie agroalimentaire, essentiellement comme agent de fluidification pour denrées en poudre ou pour absorber l'humidité dans les applications hygroscopiques. On le trouve comme anti-agglomérant dans les aliments en poudre comme les épices et les crèmes en poudre pour le café.
La silice colloïdale est utilisée comme agent de collage dans la clarification et stabilisation du vin, de la bière et des jus de fruits[37] ; son numéro E est Modèle:NrE.
Autres
Le dioxyde de silicium est utilisé dans la méthode de Modèle:Lien, applicable à l'ADN aussi bien qu'à l'ARN, en raison de la capacité du Modèle:Fchim à se lier aux acides nucléiques en présence de chaotropes[47].
Le dioxyde de silicium est le constituant principal du kieselguhr, ou terre de diatomées, dont les propriétés mécaniques particulières sont mises à profit dans de nombreuses applications, allant de l'abrasion dans le dentifrice jusqu'à l'isolation thermique en passant par la stabilisation de la nitroglycérine dans les bâtons de dynamite, la fonction d'absorbant dans les litières pour chats, les insecticides mécaniques (notamment contre les blattes), le support de catalyseurs en catalyse hétérogène, l'activation expérimentale de la coagulation sanguine en laboratoireModèle:Etc.
La Modèle:Lien peut être utilisée comme antimoussant, ou peut servir à produire de l'eau sèche, substance se présentant comme une fine poudre blanche formée de gouttelettes d'eau enrobées d'une pellicule de nanoparticules de silice.
Toxicité
Ingestion
L'ingestion de dioxyde de silicium par voie orale a été déclarée non toxique, avec une [[Dose létale médiane|LDModèle:Ind]] de Modèle:Unité[37]. Une étude de 2008 avait conclu, après avoir suivi des sujets pendant Modèle:Unité, qu'un niveau de Modèle:Fchim plus élevé dans l'eau semble réduire le risque de démence ; un ajout de Modèle:Unité de Modèle:Fchim dans l'eau potable était associé à une baisse de 11 % du risque de démence[48].
Or de nouvelles études indiquent des effets potentiellement néfastes sur la santé, « notamment des dysfonctionnements de la division cellulaire et des perturbations du trafic cellulaire[49], ainsi que des effets indésirables sur le foie »[50]. Car nous absorbons en moyenne environ 124 mg de nano-silice (E551) par jour dans notre alimentation [51].
En 2020, les fabricants de silice défendent leur produit en attaquant l'une de ces études parue en 2019[52] ; les chercheurs ont répondu dans la même revue, en démontant point par point les critiques des fabricants de silice[53].
Inhalation
Le dioxyde de silicium n'est pas toxique chimiquement, mais les poussières de silice cristalline (quartz et cristobalite, notamment) sont toxiques en raison de leur petite taille, de leur dureté et de leur inaltérabilité, essentiellement par inhalation[54]. Une exposition même brève peut provoquer une irritation des yeux et de l'appareil respiratoire. Les particules les plus fines peuvent être inhalées et atteindre les parties les plus profondes des poumons (alvéoles). Ces particules ne sont pas éliminées par l'organisme et peuvent entraîner des atteintes pulmonaires graves comme la silicose (pneumoconiose fibrosante). Elles peuvent activer l'inflammasome NLRP3 des macrophages et des cellules dendritiques et conduire ainsi à la production d'interleukine, une cytokine fortement pro-inflammatoire du système immunitaire[55]. Elles favorisent également l'apparition du cancer du poumon. Une exposition unique à de fortes doses peut entraîner des effets durables et irrémédiables, la prévention des risques est donc primordiale (protections individuelles, lutte contre la contamination de l'air, confinement). L'inhalation de telles particules en grande quantité, par exemple sur le lieu de travail, augmente le risque de développer des maladies auto-immunes telles que le lupus érythémateux disséminé et la polyarthrite rhumatoïde[56].
Les poussières de silice amorphes ne présenteraient pas ce degré de toxicité[57] car elles présentent une faible biopersistance (elles sont solubles dans les liquides biologiques).
Risques en milieu professionnel
La silice est un risque professionnel pour les personnes qui réalisent du sablage ou travaillent avec des produits contenant de la silice cristalline en poudre. La silice amorphe, telle que la silice pyrogénée, peut dans certains cas induire des lésions pulmonaires irréversibles, mais n’est pas associée au développement de la silicose. Les enfants, les asthmatiques de tous âges, les personnes allergiques et les personnes âgées, qui présentent toutes une capacité pulmonaire réduite, peuvent être atteintes plus rapidement[58].
La silice cristalline est également un risque professionnel pour ceux qui produisent des plans de travail en pierre, car le processus de découpe et d'installation des plans de travail libère de grandes quantités de silice en suspension dans l'air[59]. La silice cristalline utilisée dans la fracturation hydraulique présente également un risque pour la santé des travailleurs[60].
Notes et références
Notes
Références
Voir aussi
Articles connexes
Liens externes
- ↑ Modèle:Ouvrage
- ↑ Modèle:Article
- ↑ Modèle:Lien web.
- ↑ Modèle:Chapitre.
- ↑ Modèle:En William M. Haynes, CRC Handbook of Chemistry and Physics, Modèle:92e édition, 2011, CRC Press, États-Unis. Modèle:ISBN
- ↑ Modèle:Lien web.
- ↑ Modèle:En Y. H. Cuff, Ceramic Technology for Potters and Sculptors, Philadelphia: University of Pennsylvania, 1996, Modèle:P.. Modèle:ISBN
- ↑ Modèle:En Christina De La Rocha et Daniel J. Conley, « Mystical Crystals of Silica », Silica Stories, Springer, 2017, Modèle:P.. Modèle:DOI Modèle:ISBN
- ↑ 9,0 9,1 9,2 9,3 et 9,4 Modèle:En Arnold Frederik Holleman et Egon Wiberg, revu par Nils Wiberg, Inorganic Chemistry, traduit par Mary Eagleson et William Brewer, Academic Press/De Gruyter, San Diego/Berlin, 2001. Modèle:ISBN
- ↑ 10,0 10,1 10,2 10,3 10,4 et 10,5 Modèle:En Norman N. Greenwood et Alan Earnshaw, Chemistry of the Elements, Pergamon Press, Oxford, 1984, Modèle:P.. Modèle:ISBN
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ 15,0 et 15,1 Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Lien web.
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:En Rosemarie Szostak, Molecular sieves: Principles of Synthesis and Identification, Springer, 1998. Modèle:ISBN
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Erreur de référence : Balise
<ref>incorrecte : aucun texte n’a été fourni pour les références nommées1-58112-620-4 - ↑ Modèle:Article
- ↑ 36,0 36,1 et 36,2 Manuel Maldonado, María López-Acosta, Cèlia Sitjà, Marta García-Puig, Cristina Galobart, Gemma Ercilla & Aude Leynaert (2019) Sponge skeletons as an important sink of silicon in the global oceans ; Nature Geoscience | volume 12, pages815–822
- ↑ 37,0 37,1 37,2 et 37,3 Modèle:Article
- ↑ Modèle:En R. Doering et Y. Nishi, Handbook of Semiconductor Manufacturing Technology, CRC Press, 2007. Modèle:ISBN
- ↑ Modèle:En S. Lee, Encyclopedia of chemical processing, CRC Press, 2006. Modèle:ISBN
- ↑ Modèle:En D. V. Morgan et K. Board, (1991). An Introduction To Semiconductor Microtechnology, Modèle:2e, John Wiley & Sons, 1991, Modèle:P.. Modèle:ISBN
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:En D. V. Morgan et K. Board, (1991). An Introduction To Semiconductor Microtechnology, Modèle:2e, John Wiley & Sons, 1991, Modèle:P.. Modèle:ISBN
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ Modèle:En P. W. Atkins, T. Overton, J. Rourke, Modèle:Et al. Shriver & Atkins' inorganic chemistry, Modèle:5e, Oxford: Oxford University Press, 2010, Modèle:P.. Modèle:ISBN
- ↑ Modèle:En W. Goodwin, A. Linacre et S. Hadi, An Introduction to Forensic Genetics, Wiley & Sons, 2007, Modèle:P.. Modèle:ISBN
- ↑ Modèle:Article
- ↑ "In vitro toxicity of amorphous silica nanoparticles in human colon carcinoma cells", Nanotoxicology, 7(3), Mai 2013 "Presence of nanosilica (E551) in commercial food products: TNF-mediated oxidative stress and altered cell cycle progression in human lung fibroblast cells", Cell Biology and Toxicology, février 2014, "Sub-chronic toxicity study in rats orally exposed to nanostructured silica", Particle and Fibre Toxicology, 11:8, 2014
- ↑ "Silica nanoparticle-induced toxicity in mouse lung and liver imaged by electron microscopy', Fundamental Toxicological Sciences, 2(1) : 19-23, 2015, "Novel insights into the risk assessment of the nanomaterial synthetic amorphous silica, additive E551, in food", van Kesteren PCE et al., Nanotoxicology, 2014
- ↑ "Presence and risks of nanosilica in food products", Dekkers et al., Nanotoxicology, 5(3) : 393-405, 2011
- ↑ Boudard D et al. : "Chronic oral exposure to synthetic amorphous silica (NM-200) results in renal and liver lesions in mice", Boudard D et al., Kidney International Reports, 2019.
- ↑ site de KI Reports, le 10 mars 2020
- ↑ « Silice cristalline - Fiche toxicologique Modèle:N° », INRS, 1997
- ↑ Modèle:Article
- ↑ Modèle:Article
- ↑ « Les silices amorphes - Le point des connaissances sur… », INRS, 2007
- ↑ Modèle:Article
- ↑ Modèle:Lien web.
- ↑ Modèle:Lien web.
Erreur de référence : Des balises <ref> existent pour un groupe nommé « alpha », mais aucune balise <references group="alpha"/> correspondante n’a été trouvée